สิ่งที่คุณควรรู้:
– สำนักงานคณะกรรมการอาหารและยาแห่งสหรัฐอเมริกา (FDA) ได้ออกการอนุมัติที่สำคัญหลายประการ ซึ่งถือเป็นความก้าวหน้าที่สำคัญในการวินิจฉัย การผ่าตัด และการติดตามผู้ป่วยระยะไกล
การอนุมัติจาก FDA เหล่านี้สะท้อนให้เห็นถึงการบูรณาการที่ลึกซึ้งยิ่งขึ้นของปัญญาประดิษฐ์ (AI) และเทคโนโลยีขั้นสูงเข้ากับขั้นตอนการทำงานทางคลินิกที่ให้ความแม่นยำมากขึ้น ลดการแพร่กระจาย และขยายการเข้าถึงการรักษาพยาบาล
การวินิจฉัยและการตรวจสอบระยะไกล: AI และอุปกรณ์สวมใส่ในวงกว้าง
แนวโน้มสำคัญในการอนุมัติล่าสุดมุ่งเน้นไปที่การใช้ประโยชน์จากปัญญาประดิษฐ์และอุปกรณ์สวมใส่ที่สะดวกสบาย เพื่อปรับปรุงความเร็วในการวินิจฉัยและความต่อเนื่องของการดูแล
การตรวจติดตามหัวใจและปอดแบบพกพา
Hexoskin ได้รับการรับรอง 510(k) สำหรับการตรวจคลื่นไฟฟ้าหัวใจและการหายใจในระยะยาว

Carré Technologies Inc. (dba Hexoskin) ได้รับการรับรอง 510(k) สำหรับ Hexoskin Medical System (HMS) ของบริษัท สำหรับการติดตามคลื่นไฟฟ้าหัวใจ ระบบทางเดินหายใจ และกิจกรรมอย่างต่อเนื่องในระยะยาวในผู้ป่วยนอก ระบบนี้ซึ่งรวมถึงเสื้อไบโอเมตริกซ์อัจฉริยะ จะเป็นหนึ่งในระบบสวมใส่เกรดทางการแพทย์ระบบแรกๆ ที่สามารถวัดคลื่นไฟฟ้าหัวใจและการหายใจนอกคลินิกในระยะยาว ได้ พลิกโฉมการดูแลระยะไกลและการทดลองทางคลินิกแบบกระจายอำนาจ เทคโนโลยีนี้ช่วยให้แพทย์สามารถประเมินภาวะหัวใจเต้นผิดจังหวะ (เช่น ภาวะหัวใจห้องบน) และรูปแบบอัตราการหายใจด้วยการรวบรวมข้อมูลอย่างต่อเนื่อง
สำหรับการวิจัยทางคลินิก HMS ถือเป็นก้าวสำคัญในการก้าวไปข้างหน้า ด้วยการอนุมัติจาก FDA ขณะนี้ระบบสามารถรองรับการทดลองแบบกระจายอำนาจได้ ช่วยให้ผู้ตรวจสอบสามารถเก็บข้อมูลทางสรีรวิทยาที่มีความละเอียดสูงในโลกแห่งความเป็นจริง และพัฒนาตัวชี้วัดทางชีวภาพดิจิทัลที่ขับเคลื่อนด้วย AI ในด้านโรคหัวใจวิทยา โรคปอด ประสาทวิทยา และโรคหายาก
การถ่ายภาพหัวใจและหลอดเลือดแดงใหญ่ที่ขับเคลื่อนด้วย AI
การอนุมัติจาก FDA เสริมสร้างบทบาทของ AI ในการจัดการความเสี่ยงโรคหัวใจและหลอดเลือด:
RapidAI ได้รับการอนุมัติจาก FDA สำหรับ Rapid Aorta โดยนำ AI ทางคลินิกเชิงลึกมาใช้ในการรักษาโรคหลอดเลือดเอออร์ตา
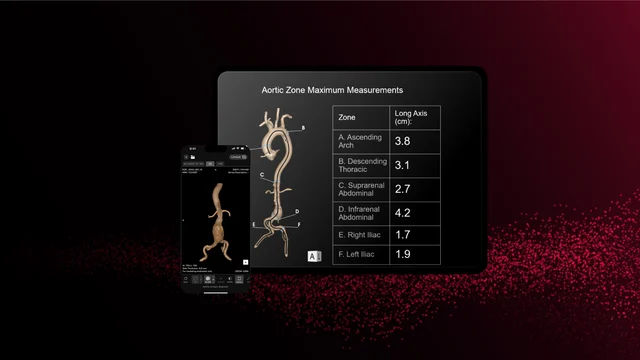
RapidAI ได้รับการอนุมัติจาก FDA สำหรับการจัดการหลอดเลือดเอออร์ติก ซึ่งเป็นส่วนหนึ่งของผลิตภัณฑ์ Rapid Aortic โซลูชัน AI ทางคลินิกเชิงลึกนี้กำลังพลิกโฉมการประเมินเฉียบพลันและการจัดการระยะยาวของโรคหลอดเลือดแดงใหญ่ โดยจะสร้างตัวชี้วัดที่สำคัญโดยอัตโนมัติ (รวมถึงโซนสูงสุดและตัวชี้วัดจุดสังเกต) สร้างแบบจำลอง 3 มิติ และติดตามการเปลี่ยนแปลงทางกายวิภาคเมื่อเวลาผ่านไป เพื่อช่วยระบุและติดตามพยาธิวิทยาตั้งแต่ส่วนโค้งของเอออร์ติกไปจนถึงอุ้งเชิงกราน
Rapid Aortic แตกต่างจากเครื่องมือคัดแยก AI แบบดั้งเดิม โดยได้รับการออกแบบมาเพื่อรองรับการดูแลผู้ป่วยตั้งแต่ต้นทางถึงปลายทาง ซึ่งได้แก่ การคัดกรอง การวินิจฉัย การวางแผนการรักษา และการเฝ้าติดตาม ความสามารถของระบบในการประมวลผลการสแกน CT ทั้งหมดที่มีเอออร์ตา ไม่ว่าจะมีคอนทราสต์หรือไม่คอนทราสต์ จะขยายประโยชน์ใช้สอยให้กับการตั้งค่าแบบเฉียบพลัน ผู้ป่วยใน และผู้ป่วยนอก
แพทย์จะได้รับประโยชน์จากภาระการรับรู้ที่ลดลง เวลาในการอ่านเร็วขึ้น และความแม่นยำที่ดีขึ้น ศัลยแพทย์สามารถใช้ประโยชน์จากการแสดงภาพที่แม่นยำสำหรับการวางแผนก่อนขั้นตอน ในขณะที่ระบบการดูแลสุขภาพได้รับการบูรณาการขั้นตอนการทำงานแบบครบวงจรผ่าน Rapid Edge Cloud และ Rapid Navigator Pro
Circle CVI ได้รับการรับรอง 510(k) สำหรับการวิเคราะห์แผ่นหลอดเลือดหัวใจที่ใช้ AI
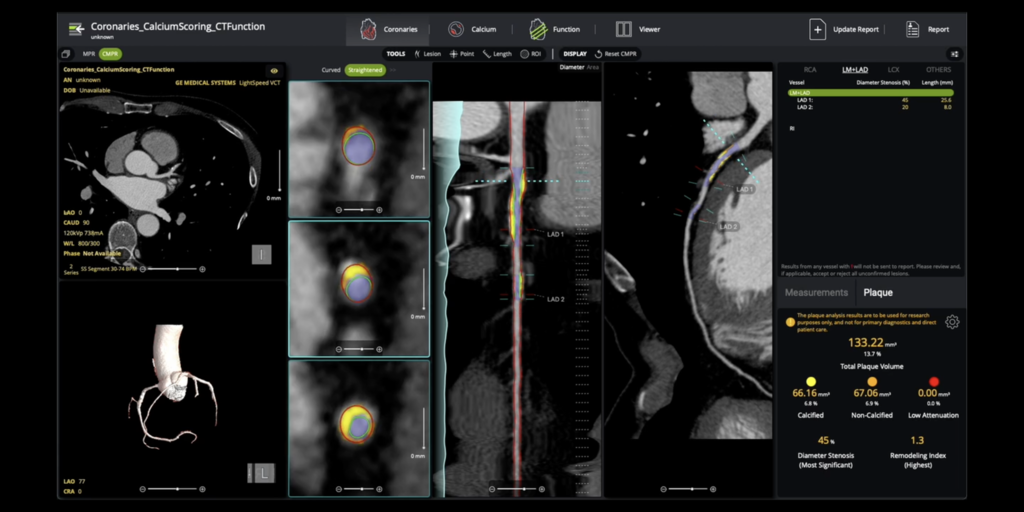
Circle Cardiovascular Imaging Inc. (Circle CVI) ได้รับการรับรอง 510(k) สำหรับ cvi42 | สารละลายคราบจุลินทรีย์สำหรับการวิเคราะห์คราบจุลินทรีย์ที่ครอบคลุม เทคโนโลยีภายในองค์กรที่เปิดใช้งาน AI นี้ จะตรวจวัดปริมาณคราบจุลินทรีย์ทั้งหมด ที่ผ่านการแคลเซียม และที่ไม่ผ่านการแคลเซียม ซึ่งสนับสนุนการแบ่งชั้นความเสี่ยงที่แม่นยำ การอนุมัติดังกล่าวเกิดขึ้นพร้อมกับรหัส Category I CPT (75XX6) ใหม่ ซึ่งจะมีผลในเดือนมกราคม 2569 ซึ่งจะทำให้ปริมาณคราบจุลินทรีย์แข็งตัวขึ้นเป็นการดูแลทางคลินิกมาตรฐาน
Bunkerhill Health ได้รับการอนุมัติจาก FDA สำหรับ AI ตัวแรกในการตรวจจับการกลายเป็นปูนวงแหวนไมตรัลใน CT หน้าอกตามปกติ

Bunkerhill Health ได้รับการอนุมัติจาก FDA เป็นครั้งแรกสำหรับอัลกอริทึม AI – Bunkerhill MAC – เพื่อตรวจจับและหาปริมาณการกลายเป็นปูนวงแหวนไมทรัล (MAC) ในการสแกน CT ทรวงอกแบบไม่มีรั้วรอบขอบชิดเป็นประจำ MAC เป็นข้อค้นพบที่มักถูกมองข้ามซึ่งสัมพันธ์กับความเสี่ยงโรคหัวใจและหลอดเลือดที่เพิ่มขึ้นและภาวะแทรกซ้อนตามขั้นตอน
เครื่องมือนี้บูรณาการเข้ากับแพลตฟอร์ม Carebricks ของ Bunkerhill โดยใช้ประโยชน์จาก AI ที่ได้รับการอนุมัติจาก FDA และการให้เหตุผลตามแบบจำลองขนาดใหญ่ เพื่อสนับสนุนการตัดสินใจติดตามผลในด้านหทัยวิทยา การดูแลเบื้องต้น และโปรแกรมโครงสร้างหัวใจ การอนุมัติดังกล่าวสะท้อนให้เห็นถึงความเชื่อมั่นในวงกว้างของ FDA ในด้านปัญญาประดิษฐ์ ซึ่งยกระดับการค้นพบแบบสุ่มให้เป็นข้อมูลเชิงลึกทางคลินิกที่สามารถนำไปปฏิบัติได้
ประสาทวิทยาศาสตร์และการจัดการความเจ็บปวด
การฝึกปรือหลายครั้งมุ่งเป้าไปที่การทำงานของสมองและอาการปวดเรื้อรัง:
QuantalX ได้รับการรับรองจาก De Novo สำหรับ Delphi-MD ซึ่งเป็นเทคโนโลยีการถ่ายภาพระบบประสาทเชิงฟังก์ชันชนิดแรก
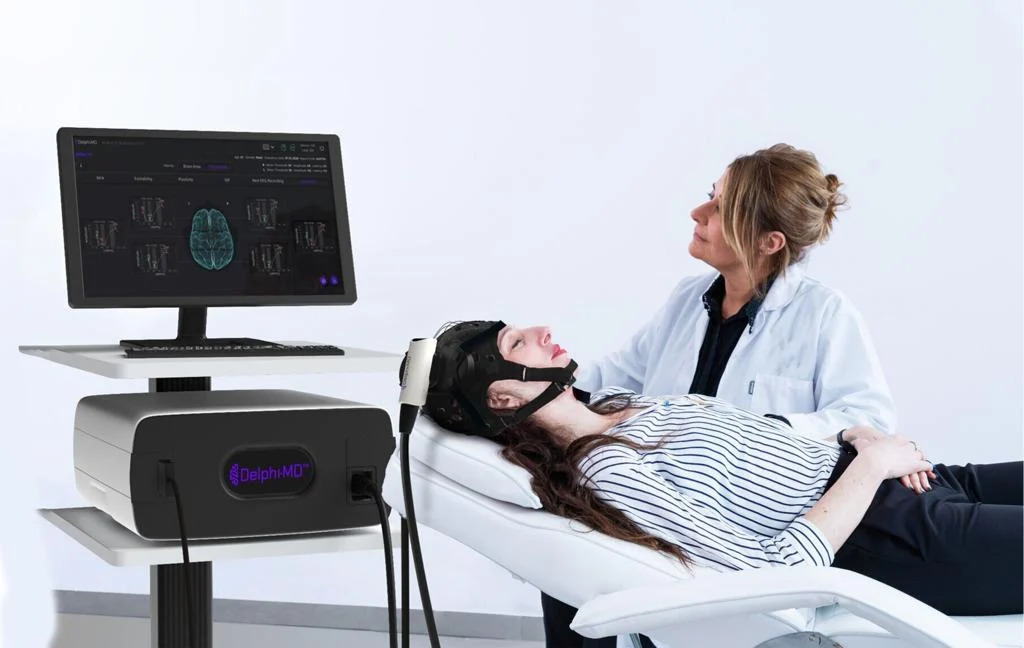
QuantalX Neuroscience ได้รับรางวัล De Novo สำหรับระบบ Delphi-MD(TM) ซึ่งถือเป็นการสร้างรูปแบบใหม่สำหรับการถ่ายภาพระบบประสาทเชิงฟังก์ชัน (FNI) Delphi-MD ผสมผสานการกระตุ้นด้วยแม่เหล็กผ่านกะโหลกศีรษะ (TMS) แบบไม่รุกล้ำเข้ากับการตรวจคลื่นไฟฟ้าสมอง (EEG) เพื่อเปรียบเทียบการทำงานของเครือข่ายสมองกับฐานข้อมูลเชิงบรรทัดฐาน
Delphi-MD ช่วยให้แพทย์ได้รับการประเมินประสิทธิภาพการทำงานของสมองโดยใช้ฐานข้อมูลเชิงบรรทัดฐานที่ได้รับการอนุมัติจาก FDA สำหรับผู้ใหญ่ที่มีสุขภาพแข็งแรง สิ่งนี้สร้างวิธีการทางคลินิกแบบใหม่ที่สามารถตรวจสอบการเสื่อมถอยของการรับรู้ ประเมินการแทรกแซงทางระบบประสาท และช่วยเหลือในการจัดการโรคทั่วสภาวะทางระบบประสาท บาดแผล หรือที่เกี่ยวข้องกับความเจ็บปวด
Magstim ได้รับการอนุมัติจาก FDA สำหรับการกระตุ้นด้วยแม่เหล็กแบบไม่รุกรานสำหรับอาการปวดเรื้อรัง
FDA อนุมัติ Magstim Magnetic Stimulation สำหรับการรักษาอาการปวดเรื้อรัง โดยเป็นทางเลือกที่ได้รับการพิสูจน์ทางคลินิก ไม่รุกราน และไม่ต้องพึ่งยา เทคโนโลยีนี้ปรับวิถีเส้นประสาทส่วนปลายโดยใช้แรงกระตุ้นแม่เหล็ก และเข้าถึงเส้นประสาทที่อยู่ลึกยิ่งขึ้นโดยไม่ต้องมีการปลูกถ่ายหรือยาที่รุกราน
เทคโนโลยีของ Magstim ซึ่งอ้างถึงในการศึกษาทางวิทยาศาสตร์มากกว่า 15,000 รายการ ให้การกระตุ้นเส้นประสาทได้ลึกกว่าเมื่อเทียบกับ TENS แบบดั้งเดิมหรืออุปกรณ์ระดับพื้นผิว ซึ่งเป็นทางเลือกที่สำคัญสำหรับผู้ป่วยที่การรักษาแบบเดิมๆ ยังไม่เพียงพอ
หุ่นยนต์ผ่าตัดและศัลยกรรมกระดูกที่มีความแม่นยำ
นวัตกรรมในการช่วยเหลือด้วยหุ่นยนต์มุ่งหวังที่จะปรับปรุงความแม่นยำและลดการบาดเจ็บ:
Zimmer Biomet เคลียร์ข้อเข่า ROSA ได้ 510(k) ด้วย OptimiZe ช่วยเพิ่มความแม่นยำของหุ่นยนต์ในด้านศัลยกรรมกระดูก
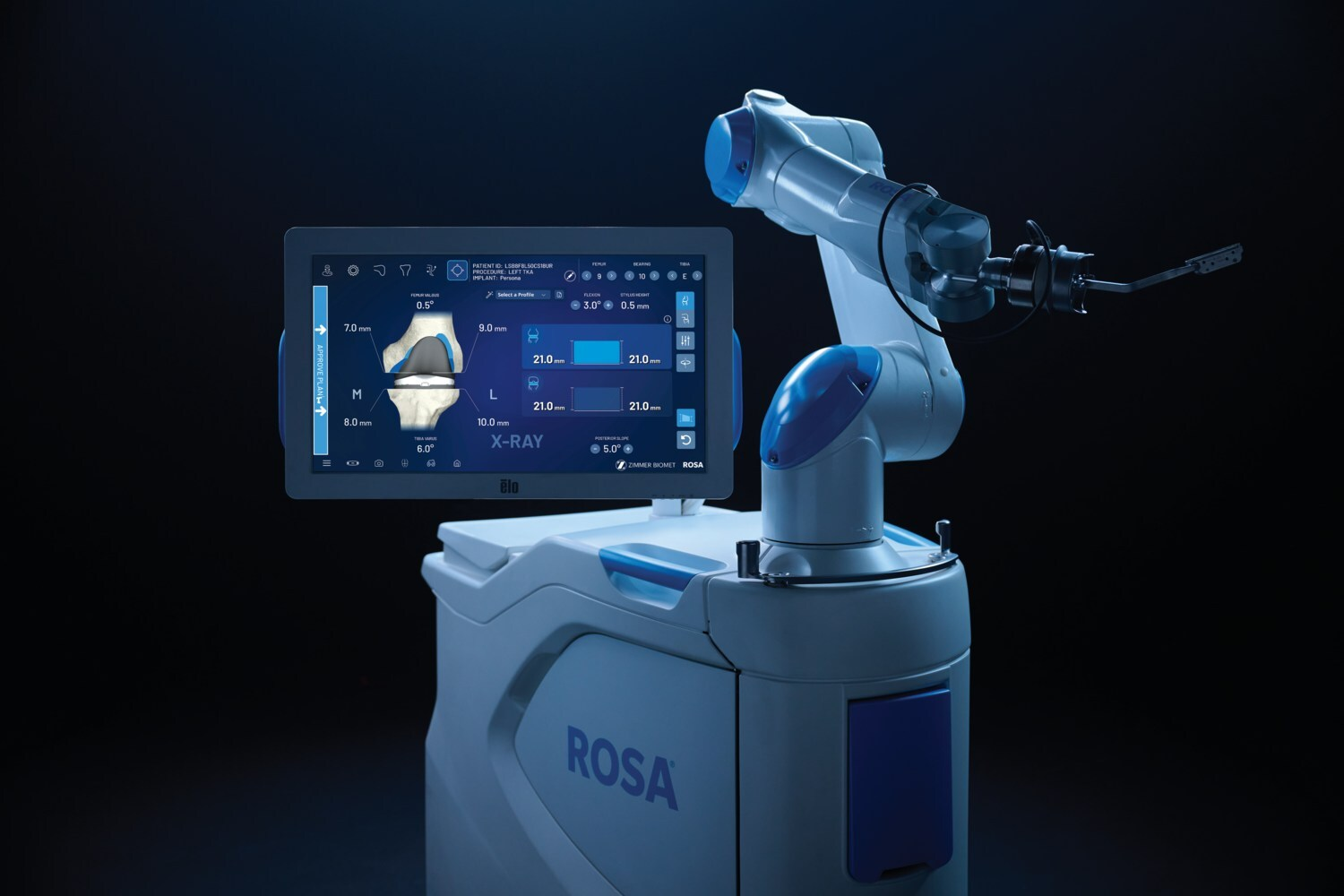
Zimmer Biomet ประสบความสำเร็จในการกวาดล้าง ROSA® Knee ด้วย OptimiZe™ ได้ถึง 510(k) ซึ่งเป็นระบบหุ่นยนต์เวอร์ชันปรับปรุงสำหรับการผ่าตัดเปลี่ยนข้อเข่าทั้งหมด เทคโนโลยีนี้นำเสนอการวางแผนการผ่าตัดอัจฉริยะที่ปรับแต่งตามความต้องการและคุณสมบัติต่างๆ เช่น OptimiZe Kinematic Alignment™ ซึ่งเป็นคุณสมบัติการจัดตำแหน่งจลนศาสตร์แบบอัตโนมัติเพียงแห่งเดียวของอุตสาหกรรม เพื่อให้มั่นใจถึงผลลัพธ์ที่แม่นยำและทำซ้ำได้ โดยอิงตามลักษณะทางกายวิภาคของผู้ป่วยและความต้องการของศัลยแพทย์
ROSA Knee พร้อม OptimiZe ผสานรวมกับ ZBEdge® Analytics ช่วยให้สามารถตัดสินใจโดยอาศัยข้อมูล ข้อมูลเชิงลึกระหว่างการผ่าตัดแบบเรียลไทม์ และการประเมินประสิทธิภาพอย่างต่อเนื่อง การเปิดตัวแบบกำหนดเป้าหมายจะเริ่มในปลายปีนี้ โดยคาดว่าจะวางจำหน่ายเชิงพาณิชย์ในสหรัฐฯ ต้นปี 2569
Levita Magnetics ได้รับการรับรองจากเด็กสำหรับระบบการผ่าตัดด้วยแม่เหล็ก (MSS)
Levita® Magnetics ได้รับการอนุมัติจาก FDA สำหรับระบบการผ่าตัดด้วยแม่เหล็ก (MSS) สำหรับผู้ป่วยเด็ก เทคโนโลยีนี้ใช้แม่เหล็กภายนอกเพื่อควบคุมเครื่องมือผ่าตัดภายใน ช่วยลดจำนวนแผลที่จำเป็นสำหรับขั้นตอนต่างๆ เช่น การผ่าตัดถุงน้ำดีผ่านกล้อง ซึ่งจำเป็นต่อการลดการบาดเจ็บและรอยแผลเป็นในเด็ก
Cleveland Clinic Children’s กลายเป็นศูนย์แห่งแรกที่ทำการรักษาผู้ป่วยเด็กโดยใช้เทคโนโลยีนี้ สำหรับผู้ป่วยอายุน้อย การลดการบาดเจ็บของเนื้อเยื่อเป็นสิ่งสำคัญ: การลดพอร์ตช่วยให้ฟื้นตัวเร็วขึ้น ลดความเจ็บปวด ลดรอยแผลเป็น และลดความเสี่ยงของภาวะแทรกซ้อน
FDA อนุมัติการศึกษาการผ่าตัดด้วยหุ่นยนต์ครั้งแรกเพื่อการแทรกแซงโรคอัลไซเมอร์

MMI (Medical Microinstruments, Inc.) ได้รับการอนุมัติ FDA Investigational Device Exemption (IDE) สำหรับการศึกษาทางคลินิก REMIND โดยใช้ Symani® Surgical System สำหรับการแทรกแซงทางจุลศัลยกรรมแบบใหม่สำหรับโรคอัลไซเมอร์ การศึกษานี้มีจุดมุ่งหมายเพื่อสร้างเส้นทางการระบายน้ำเหลืองในต่อมน้ำเหลืองบริเวณปากมดลูกส่วนลึก เพื่อปรับปรุงการขับถ่ายโปรตีนที่เป็นอันตราย ขั้นตอนนี้ต้องใช้ความแม่นยำระดับจุลภาค โดยผ่าตัดบนภาชนะที่มีขนาดเล็กเพียง 0.2 มม.
การดูแลบาดแผลและการรักษาโรคเบาหวาน
Rapid Nexus ได้รับการรับรอง 510(k) สำหรับ Hemastyl ซึ่งเป็นความก้าวหน้าครั้งใหม่ในการรักษาบาดแผลเรื้อรัง
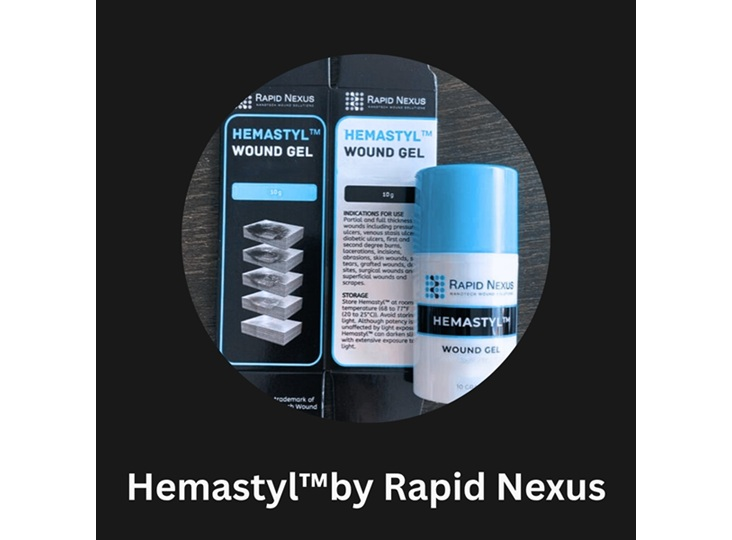
Rapid Nexus Nanotech Wound Solutions, Inc. ได้รับการรับรองจาก FDA 510(k) สำหรับอุปกรณ์เจล Hemastyl เจลเป็นอุปกรณ์ชิ้นแรกที่ใช้รักษาสภาพแวดล้อมของเนื้อเยื่อรอบแผลโดยตรง ซึ่งเป็นขอบที่มีชีวิตซึ่งมีหน้าที่ในการรักษาที่หยุดชะงัก เพื่อฟื้นฟูสภาวะการปิดแผล และช่วยให้ผู้ป่วยหลีกเลี่ยงการตัดแขนขา
Rapid Nexus วางแผนที่จะดำเนินการตามการกำหนดอุปกรณ์ที่ก้าวหน้าของ FDA ซึ่งอาจเร่งรัดกระบวนการครอบคลุมและการชำระเงินคืน ทำให้การรักษานี้ใช้ได้กับผู้ป่วยที่มีความเสี่ยงสูงหลายล้านรายทั่วประเทศ การกวาดล้างเป็นช่วงเวลาต้นน้ำสำหรับการรักษาบาดแผล ซึ่งเป็นพื้นที่ที่มีมานานแล้วโดยอาศัยอาการมากกว่าแนวทางการรักษาเชิงสาเหตุ
Tandem Diabetes Care ได้รับการอนุมัติจาก FDA สำหรับแอป Tandem Mobi สำหรับผู้ใช้ Android
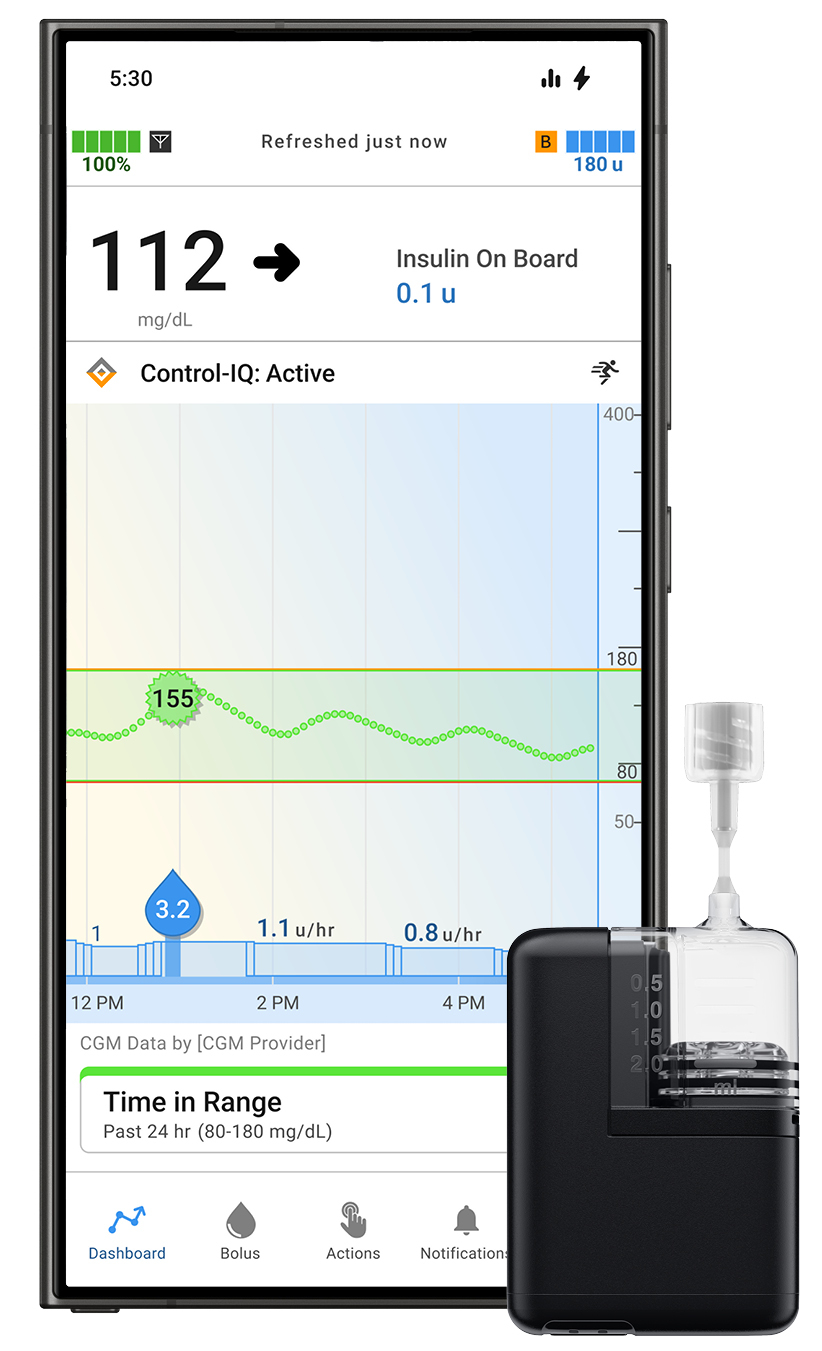
Tandem Diabetes Care, Inc. ได้รับการอนุมัติจาก FDA สำหรับแอปมือถือ Tandem Mobi เวอร์ชัน Android สิ่งนี้ช่วยให้ผู้ใช้ Android สามารถจัดการโรคเบาหวานได้โดยตรงจากสมาร์ทโฟนที่รองรับโดยใช้ระบบส่งอินซูลินอัตโนมัติ Tandem Mobi ที่ขับเคลื่อนโดยเทคโนโลยี Control-IQ +
การเปิดตัวครั้งนี้ช่วยขยายการเข้าถึงอย่างมีนัยสำคัญสำหรับผู้ป่วยที่ชื่นชอบอุปกรณ์ Android ซึ่งปรับปรุงความสะดวกในการใช้งานและการปฏิบัติตามข้อกำหนดของผู้ป่วย คาดว่าจะวางจำหน่ายในจำนวนจำกัดในช่วงปลายปี 2568 และวางจำหน่ายเชิงพาณิชย์ในต้นปี 2569
