การเกิดขึ้นของปัญญาประดิษฐ์ (AI) และการเรียนรู้ของเครื่องจักร (ML) ในระบบการดูแลสุขภาพได้เปลี่ยนโฉมหน้าอุตสาหกรรม และเนื่องจากการเดินขบวนเมื่อเร็ว ๆ นี้ของ CHATGPT และเครื่องมือที่คล้ายกันอัลกอริทึม AI ต่าง ๆ ได้เข้าสู่ชีวิตของประชากรทั่วไปเช่นกัน เทคโนโลยีเหล่านี้จะเปลี่ยนวิธีการใช้ยาอย่างไม่ต้องสงสัย เนื่องจากการดูแลสุขภาพเป็นอุตสาหกรรมที่การตัดสินใจอาจเป็นเรื่องของชีวิตและความตายอย่างแท้จริงความสำคัญของกฎระเบียบที่มีประสิทธิภาพไม่สามารถพูดเกินจริงได้ ตอนนี้นี่เป็นความท้าทายแม้สำหรับมืออาชีพที่มีประสบการณ์มากที่สุด
AI และ ML นำเสนอความท้าทายด้านกฎระเบียบใหม่ เทคโนโลยีเหล่านี้สามารถพัฒนาและเรียนรู้ได้ตลอดเวลา ซึ่งหมายความว่าพวกเขาสามารถทำงานได้แตกต่างกันในโลกแห่งความเป็นจริงมากกว่าที่พวกเขาทำในระหว่างการทดสอบก่อนตลาด แม้ว่าสิ่งนี้อาจหมายถึงผลลัพธ์ของผู้ป่วยที่ได้รับการปรับปรุง แต่ก็สามารถแนะนำความเสี่ยงใหม่ที่จะควบคุมได้ ซึ่งไม่ใช่เรื่องง่ายด้วยอัลกอริทึมที่เปลี่ยนแปลงอยู่ตลอดเวลา

ในอดีตองค์การอาหารและยาเป็นผู้บุกเบิกระดับโลกในการควบคุมเทคโนโลยีการดูแลสุขภาพใหม่ จากยาเสพติดยาไปจนถึงอุปกรณ์การแพทย์องค์การอาหารและยาได้รับมาตรฐานตามธรรมเนียมไม่น่าแปลกใจที่ทุกสายตาดูเหมือนจะอยู่ในหน่วยงานกำกับดูแลของสหรัฐอเมริกาในทุกวันนี้
ตามเนื้อผ้าองค์การอาหารและยาอัพเดทฐานข้อมูล AI-Octivated ปีละครั้งเสมอในฤดูใบไม้ร่วงดังนั้นจึงถึงเวลาที่จะดูสิ่งที่เราสามารถเรียนรู้ได้จากสถิติล่าสุดที่มีอยู่
ขณะนี้ฐานข้อมูล FDA มีทั้งหมด 1250 หน่วย (เพิ่มขึ้นจาก 950 ปีที่แล้ว) ตั้งแต่เดือนกรกฎาคม 2568 อุปกรณ์ไม่ได้รับการอนุมัติที่ใช้ AI กำเนิดหรือขับเคลื่อนด้วยโมเดลภาษาขนาดใหญ่
จากศูนย์ถึงทั้งหมด
ไม่กี่ปีที่ผ่านมาภูมิทัศน์ด้านกฎระเบียบสำหรับเทคโนโลยี AI และ ML เกือบจะไม่มีอยู่จริง การอนุมัติของอุปกรณ์การแพทย์ไม่ได้ระบุอย่างชัดเจนว่าเทคโนโลยีนั้นใช้ AI หรือไม่ สิ่งนี้ทำให้เป็นเรื่องยากสำหรับผู้เชี่ยวชาญด้านการดูแลสุขภาพผู้ป่วยและผู้มีส่วนได้ส่วนเสียอื่น ๆ ที่จะเข้าใจขอบเขตที่ AI ถูกรวมเข้ากับโซลูชั่นสุขภาพ นักประดิษฐ์และนักพัฒนายังถูกขัดขวางอย่างรุนแรงเนื่องจากพวกเขาไม่เห็นเส้นทางที่ชัดเจนในการอนุมัติตลาดของเทคโนโลยีใหม่ มันเป็นสิ่งสำคัญที่จะแยกแยะความแตกต่างระหว่างเทคโนโลยีที่ใช้ AI เหล่านี้เนื่องจากพวกเขามีข้อควรพิจารณาและผลกระทบที่ไม่ซ้ำกันสำหรับผู้ใช้และผู้ป่วย
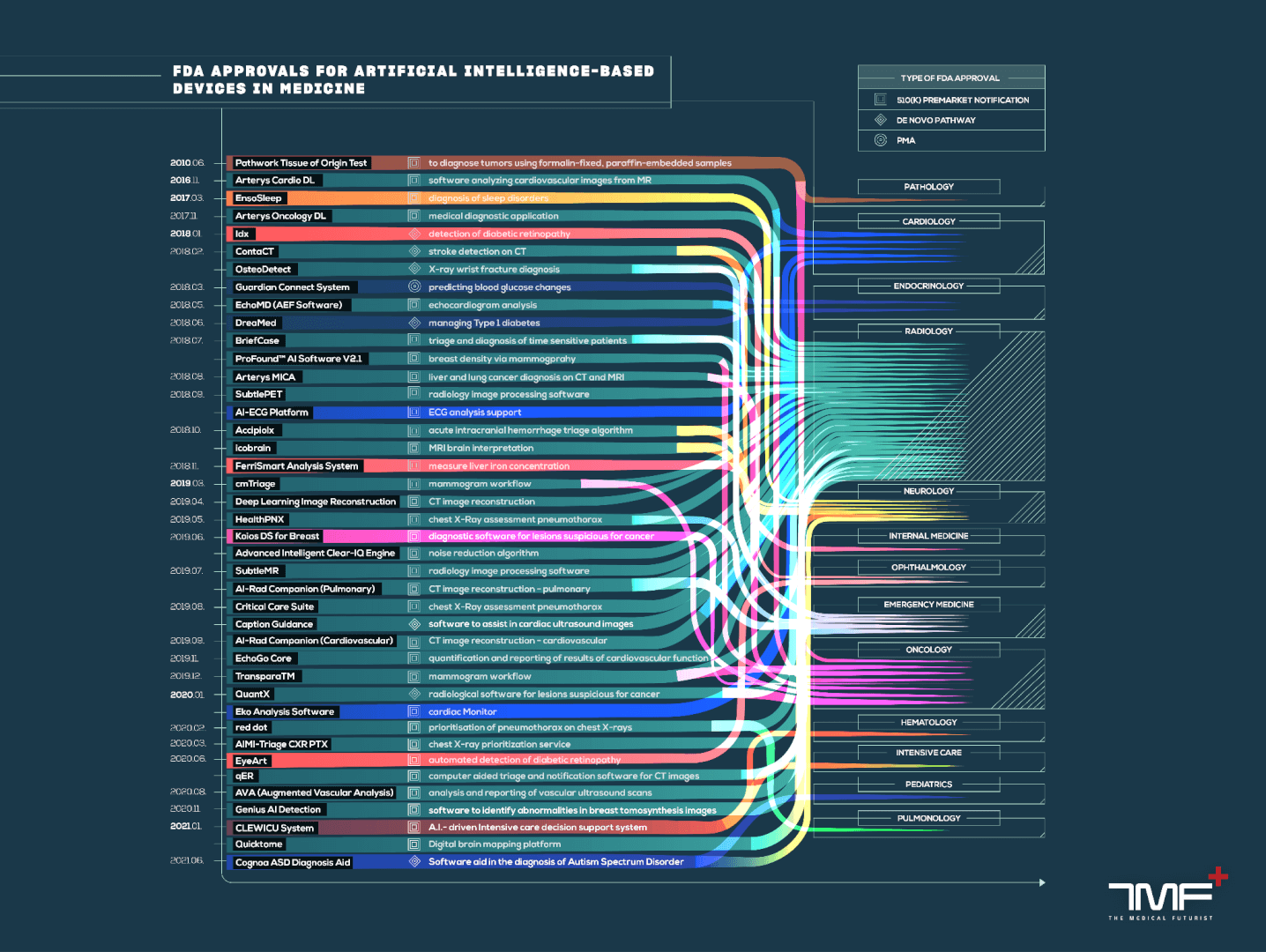
องค์การอาหารและยาได้อนุมัติอุปกรณ์ที่ใช้ AI มานานหลายปี แต่ไม่ได้แยกแยะว่าเป็นหมวดหมู่ที่ไม่ซ้ำกัน ไม่กี่ปีที่ผ่านมาเราไปที่สถาบันการแพทย์แห่งอนาคตเพื่อให้เราเงียบลงผ่านการอนุมัติทั้งหมดเหล่านี้และระบุผู้ที่อยู่ใน AI จากงานของเราเราสร้างฐานข้อมูลการเข้าถึงแบบเปิดที่เราแบ่งปันกับ FDA เพื่อให้พวกเขาสามารถสร้างงานพื้นฐานของเราได้ เพื่อความพึงพอใจของเราหนึ่งปีต่อมาองค์การอาหารและยาได้เผยแพร่ฐานข้อมูลของตัวเองและอ้างถึงเราเป็นแหล่งที่มา
การเติบโตแบบทวีคูณที่เรากำลังเป็นพยานอยู่ในขณะนี้
ในวันที่ฐานข้อมูลล่าสุดแสดงการอนุมัติทั้งหมด 1,250 การอนุมัติ ดูว่าตัวเลขนี้เพิ่มขึ้นเพียงใด:
- ในปี 2560 องค์การอาหารและยาได้อนุมัติ 27 หน่วย
- ในปี 2561 65 หน่วย
- ในปี 2562 80 หน่วย
- ในปี 2020 114 หน่วย
- ในปี 2021, 130 หน่วย
- ในปี 2022, 162 หน่วย
- ในปี 2023, 226 หน่วย
- ในปี 2024, 235 หน่วย
- ในปี 2025 จนถึงขณะนี้ 148 หน่วย
พิเศษใดที่ได้รับผลกระทบมากที่สุด?
จากการวิเคราะห์ข้อมูลล่าสุดของเรารังสีวิทยาปรากฏเป็นผู้เชี่ยวชาญด้านการแพทย์ที่ลงทุน AI มากที่สุดและมีอุปกรณ์ที่ได้รับการรับรองจำนวน 956 เครื่อง วินาทีที่ห่างไกลคือโรคหัวใจหรือหัวใจและหลอดเลือด (เป็นหมวดหมู่) ที่มีอุปกรณ์ 116 เครื่อง
นอกจากนี้ความเชี่ยวชาญพิเศษอื่น ๆ (ประสาทวิทยา, โลหิตวิทยา, ระบบทางเดินอาหารระบบทางเดินอาหารและจักษุแพทย์ในหมู่คนอื่น ๆ ) ดูหน่วยจำนวนหนึ่ง ความคืบหน้าของการถ่ายภาพความสูงดังกล่าวคืออะไร? การเรียนรู้อย่างลึกซึ้งพบเหตุผลที่มีผลในรังสีวิทยาที่ส่วนใหญ่เป็นข้อมูล
นี่คือรายการทั้งหมด:
- ระบบทางเดินอาหาร/ระบบทางเดินปัสสาวะ 17
- วิสัญญีวิทยา 22
- ประสาทวิทยา 56
- โลหิตวิทยา 19
- จักษุ 10
- เคมีคลินิก 9
- ทันตกรรม 6
- ศัลยกรรมทั่วไปและพลาสติก 6
- จุลชีววิทยา 6
- พยาธิวิทยา 6
- พิษวิทยาคลินิก 5
- ศัลยกรรมกระดูก 5
- โรงพยาบาลทั่วไป 4
- สูติศาสตร์และนรีเวชวิทยา 3
ประเภทการส่ง FDA
องค์การอาหารและยารับรู้การส่งสามประเภทที่แตกต่างกัน: 510 (k) การอนุมัติก่อนตลาดและเส้นทางโนโว ด้วยการยิงยาว
- 510 (k) เป็นที่นิยมมากที่สุดในบรรดา 1195 (+271 ตั้งแต่ปีที่แล้ว) การอนุมัติจนถึงตอนนี้
- ออกจากอีก 36 (+14)
- และก่อนตลาด 16 (+12) ไกลออกไป
ไม่น่าแปลกใจที่ 510 (k) เป็นที่นิยมเพียงแค่บอกว่ามันเป็นเส้นทางที่ง่ายที่สุดเนื่องจากเป็นเส้นทางที่ใช้สำหรับหน่วยที่มีความคล้ายคลึงกับหน่วยการตลาดตามกฎหมายอื่น ไม่จำเป็นต้องมีการทดลองทางคลินิกใหม่แม้ว่า บริษัท จะต้องพิสูจน์ว่าหน่วยของพวกเขาปลอดภัยและมีประสิทธิภาพเท่าที่ได้รับการอนุมัติแล้ว
ในขณะเดียวกันการอนุมัติของตลาดก่อนเป็นกระบวนการทางการตลาดที่เข้มงวดที่สุด มันเป็นหน่วยที่มีความเสี่ยงสูงและต้องการให้ผู้ผลิตให้การพิสูจน์ทางคลินิกที่แสดงความปลอดภัยและประสิทธิภาพของอุปกรณ์ สิ่งนี้มักเกี่ยวข้องกับการทดลองทางคลินิกซึ่งทำให้มีราคาแพง

De Novo Path เป็นเส้นทางที่มีกฎระเบียบไปยังหน่วยที่มีความเสี่ยงต่ำไปจนถึงความเสี่ยงปานกลางที่ใหม่และไม่มีหน่วยงานหลักที่ถูกกฎหมาย เหมาะสำหรับคลาส I หรือ II (การจำแนกประเภทความเสี่ยงต่ำกว่า)
และนี่คือ “รายการยอดนิยมขององค์กร” บริษัท เหล่านี้เป็น บริษัท ที่มีอุปกรณ์ AI-Activated ที่ได้รับการอนุมัติมากที่สุด:
- GE Healthcare: 84
- Siemens Healthineers: 76
- ฟิลิปส์: 32
- Canon: 35
- Aidoc: 30
- เซี่ยงไฮ้ยูไนเต็ดสติปัญญาการถ่ายภาพ: 32
เราจะดำเนินการตรวจสอบสาขานี้ต่อไปเนื่องจากวิธีการขององค์การอาหารและยาสามารถกำหนดแบบอย่างที่มีค่าของหน่วยงานกำกับดูแลในประเทศอื่น ๆ ดังนั้นจึงกระชับขึ้นและอยู่เสมอ – จะมีอะไรให้เรียนรู้มากมายในอีกไม่กี่ปีข้างหน้า
โพสต์สถานะปัจจุบันของอุปกรณ์การแพทย์ที่ได้รับการอนุมัติจากองค์การอาหารและยากว่า 1,250 คนที่ได้รับการอนุมัติจาก FDA ปรากฏตัวครั้งแรกในนักการแพทย์แห่งอนาคต
