การดื้อยาปฏิชีวนะเป็นปัญหาที่เพิ่มขึ้น ตั้งแต่สุขภาพของมนุษย์ไปจนถึงการอยู่รอดของพืชผล การศึกษาใหม่ประสบความสำเร็จในการใช้นาโนเจลเพื่อโจมตีแบคทีเรียและยับยั้งพวกมันได้เกือบทั้งหมด พี. แอรูจิโนส.
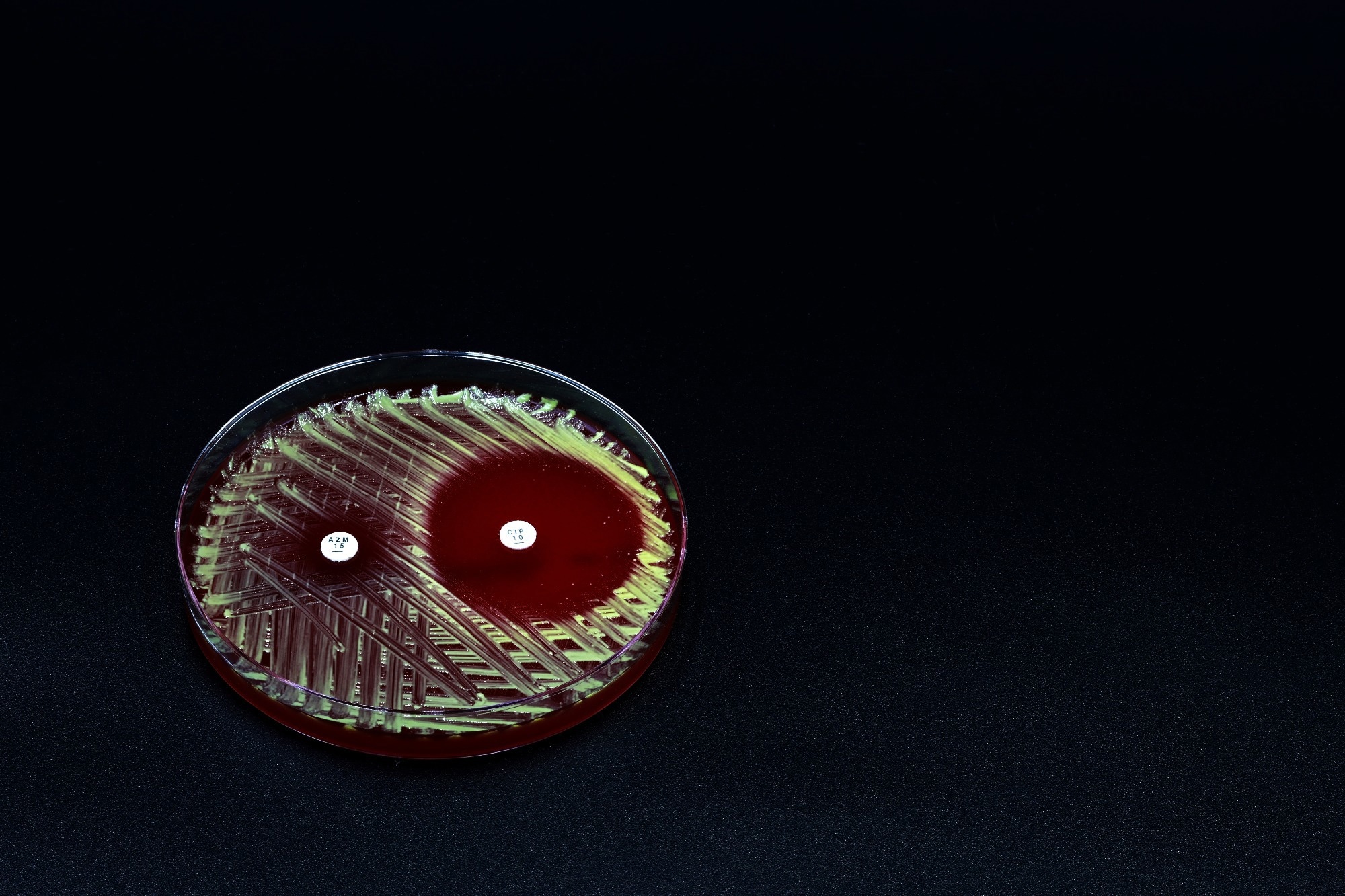 การศึกษา: นาโนเจลเฮเทอโรมัลติวาเลนท์เป็นตัวยับยั้งที่แข็งแกร่งมากของเชื้อ Pseudomonas Aeruginosa เครดิตภาพ: TopMicrobialStock/Shutterstock.com
การศึกษา: นาโนเจลเฮเทอโรมัลติวาเลนท์เป็นตัวยับยั้งที่แข็งแกร่งมากของเชื้อ Pseudomonas Aeruginosa เครดิตภาพ: TopMicrobialStock/Shutterstock.com
เผยแพร่ล่าสุดใน เคมีประยุกต์การทดสอบแสดง 99.9 % การเบรกที่มีประสิทธิภาพ พี. แอรูจิโนสแบคทีเรียที่หลบเลี่ยงได้เป็นพิเศษ
ด้วยการรวมลิแกนด์น้ำตาลที่จำเพาะต่อเชื้อโรคเข้ากับเปปไทด์ต้านจุลชีพที่ขัดขวางเมมเบรน ระบบจึงแสดงให้เห็นถึงประสิทธิภาพสูงในการต่อต้านแบคทีเรียแพลงก์ตอนและแผ่นชีวะที่สร้างขึ้น: สภาพแวดล้อมสองแห่งที่ยาปฏิชีวนะทั่วไปมักจะล้มเหลว
P. aeruginosa เป็นสาเหตุหลักของการติดเชื้อในโรงพยาบาลโดยเฉพาะในผู้ป่วยที่มีภาวะภูมิคุ้มกันบกพร่อง ความสามารถในการสร้างแผ่นชีวะช่วยให้หลบเลี่ยงยาปฏิชีวนะและปฏิกิริยาภูมิคุ้มกันได้
ในการศึกษานี้ นาโนเจลถูกนำเสนอว่าเป็นวิธีแก้ปัญหาที่มีแนวโน้มสำหรับความท้าทายนี้ โครงสร้างที่ปรับได้รองรับการทำงานแบบมัลติฟังก์ชั่น ทำให้เหมาะสำหรับการพกพาสารรักษาโรค และทำให้มีปฏิกิริยาโต้ตอบหลายวาเลนท์ที่ปรับปรุงการกำหนดเป้าหมายของจุลินทรีย์
ดูรายละเอียดทั้งหมด: ดาวน์โหลด PDF ที่นี่!
โครงสร้างนาโนเจลแบบสองฟังก์ชัน
นักวิจัยสร้างนาโนเจลโดยใช้ dendritic polyglycerols (dPG) ที่ทำงานด้วยน้ำตาล 2 ชนิด ได้แก่ ลิแกนด์ฟูโคส (Fuc) และกาแลคโตส (Gal) น้ำตาลเกาะติดกัน P. aeruginosa เลคติน LecB และ LecA จากนั้นจึงรวมเข้ากับเปปไทด์ต้านเชื้อแบคทีเรีย BMAP-18 (GRFKRFRKKFKKLFKKLS) ซึ่งเป็นที่รู้จักในเรื่องของการรบกวนเมมเบรน
กรอบการทำงานนี้หวังที่จะทำลายเมมเบรนป้องกันที่ทำให้สิ่งนี้เป็นไปได้ P. aeruginosa พัฒนาแม้จะมียาปฏิชีวนะชนิดอื่นแล้วยับยั้งการเจริญเติบโตของแบคทีเรียได้เกือบทั้งหมด
นาโนเจลถูกสังเคราะห์โดยการเชื่อมโยงข้ามไทโอลีนที่ถูกเหนี่ยวนำด้วยแสงของมาโครโมโนเมอร์ dPG ที่ประกอบด้วยนอร์บอร์นและไทออลโดยใช้การตกตะกอนนาโนแบบย้อนกลับ
ในบรรดาการเตรียมต่างๆ หลายชนิด NG0.33 (การเตรียมนาโนเจลที่มีปริมาณมาโครโมโนเมอร์ 33%) แสดงการจับภายในที่แข็งแกร่งที่สุดกับแบคทีเรีย นักวิทยาศาสตร์เชื่อว่าความสำเร็จนี้เกิดจากการปรับความยืดหยุ่นให้เหมาะสม ทำให้เป็นตัวเลือกหลักสำหรับการปรับเปลี่ยนเพิ่มเติม
หลังจากการผันกับน้ำตาลและ BMAP-18 ขนาดนาโนเจลเพิ่มขึ้นจาก 47 นาโนเมตรเป็นประมาณ 80 นาโนเมตร และศักย์ซีตาเพิ่มขึ้นจาก +35 mV เป็น +45 mV ซึ่งยืนยันการทำงานที่ประสบความสำเร็จ
ที่สำคัญนาโนเจลยังคงมีโครงสร้างที่ค่า pH ที่เกี่ยวข้องกับการติดเชื้อ (5.0–7.0) เป็นเวลาอย่างน้อยห้าวัน
ประสิทธิภาพเกือบจะสมบูรณ์แบบในการต่อต้านเซลล์แพลงก์ตอนและแผ่นชีวะ
นาโนเจลดัดแปลงน้ำตาลมีความสัมพันธ์กับทั้งแพลงก์ตอนและสารที่เกี่ยวข้องกับแผ่นชีวะมากขึ้น P. aeruginosa ในโฟลว์ไซโตเมทรีและกล้องจุลทรรศน์ฟลูออเรสเซนซ์ ที่สำคัญผลการศึกษาพบว่าการเติม BMAP-18 ไม่ส่งผลต่อการจับกับเลคติน
ที่ความเข้มข้นเพียง 8 ไมโครกรัม/มิลลิลิตร นาโนเจลเปปไทด์-น้ำตาล (PNG0.33-Fuc/Gal) ยับยั้งการทำงานของแบคทีเรียแพลงก์ตอนมากกว่า 99.99% ภายใน 12 ชั่วโมง และคงฤทธิ์ฆ่าเชื้อแบคทีเรียได้อย่างต่อเนื่องนานกว่า 72 ชั่วโมง
การทดลองควบคุมยังแสดงให้เห็นว่านาโนเจลที่มีน้ำตาลเพียงอย่างเดียวสามารถลดการอยู่รอดของแบคทีเรียได้ในตอนแรก แต่เมื่อเวลาผ่านไป แบคทีเรียก็กลับมาเติบโตอีกครั้ง โดยเน้นถึงความจำเป็นในการกำหนดเป้าหมายและกลยุทธ์การฆ่าแบบผสมผสาน
ในกรณีของแผ่นชีวะ นาโนเจลชนิดเดียวกันช่วยให้สามารถกำจัดเมทริกซ์ได้เกือบสมบูรณ์หลังจากการฟักตัวร่วม 72 ชั่วโมง และลดความหนาของแผ่นชีวะที่เติบโตเต็มที่ 72 ชั่วโมงลง 65% หลังการรักษา 12 ชั่วโมง ซึ่งให้ผลลัพธ์ที่เทียบเท่ากับโทบรามัยซิน
มากกว่า 99.9 % ไบโอฟิล์มที่สะสม P. aeruginosa เซลล์ถูกปิดใช้งาน ซึ่งบ่งชี้ถึงการแทรกซึมและการหยุดชะงักที่มีประสิทธิภาพ โครงสร้างฟิล์มชีวะ
ศักยภาพในวงกว้างและความเข้ากันได้ทางชีวภาพ
นาโนเจลยังยับยั้งการเจริญเติบโตของแบคทีเรียอื่นๆ ได้อย่างมีประสิทธิภาพ โดยสามารถยับยั้งได้ประมาณ 90% อี. โคไล และ MRSA ในปริมาณที่สูงขึ้น (32 ไมโครกรัม/มิลลิลิตร และ 16 ไมโครกรัม/มิลลิลิตร ตามลำดับ)
กิจกรรมนี้อาจสะท้อนถึงความสัมพันธ์ตามธรรมชาติที่สูงกว่าของกาแลคโตสสำหรับเลคตินของแบคทีเรียเหล่านี้ รวมกับกิจกรรมของเมมเบรนของ BMAP-18
การทดสอบความเข้ากันได้ทางชีวภาพแสดงให้เห็นความสามารถในการอยู่รอดของไฟโบรบลาสต์มากกว่า 80% ที่ความเข้มข้นสูงถึง 1 มก./มล. โดยไม่มีภาวะเม็ดเลือดแดงแตกที่วัดได้ ซึ่งบ่งชี้ถึงโปรไฟล์ด้านความปลอดภัยที่ดีสำหรับการทดสอบพรีคลินิกเพิ่มเติม
แพลตฟอร์มแบบแยกส่วนสำหรับยาต้านจุลชีพรุ่นต่อไป
ด้วยการรวมน้ำตาลที่มีเป้าหมายเป็นเลคตินเข้ากับเปปไทด์ต้านจุลชีพที่มีศักยภาพ นาโนเจลเฮเทอโรมัลติวาเลนต์จะขจัดจุดอ่อนของระบบฟังก์ชันเดียว และเน้นย้ำถึงข้อดีของการผสมผสานการรับรู้แบบเลือกสรรเข้ากับฤทธิ์ฆ่าเชื้อแบคทีเรียที่มีอายุการใช้งานยาวนาน
ความเป็นโมดูลบ่งชี้ว่าสามารถปรับให้เข้ากับการโจมตีเชื้อโรคอื่นๆ ได้โดยการเปลี่ยนส่วนประกอบลิแกนด์หรือเปปไทด์
งานในอนาคตจะต้องมีการประเมินก่อน มีชีวิตอยู่ ประสิทธิภาพ ตลอดจนความสามารถในการปรับขนาดการผลิต และการผสมผสานลิแกนด์-เปปไทด์ที่ขยายออกไป
เนื่องจากการดื้อยาปฏิชีวนะยังคงเพิ่มขึ้น ระบบนาโนเจลที่ปรับแต่งได้ดังกล่าวจึงเป็นก้าวแรกที่สำคัญในการพัฒนายาต้านการติดเชื้อ
การอ้างอิงนิตยสาร
หยูหัง เจ.ดี. และคณะ– (พ-ศ- 2568 พฤศจิกายน) Heteromultivalent nanogels เป็นตัวยับยั้งที่แข็งแกร่งมากของ Pseudomonas Aeruginosa เคมีประยุกต์ฉบับนานาชาติ– e13121– ดอย: 10-1002/anie-202513121
